Glycopeptide Synthesis
[要約]
このページでは、酸に弱い糖鎖を用いて、酸処理を多用するペプチド固相合成法により糖ペプチドを合成する方法を確立したことについて述べる。
[糖ペプチドの固相合成]
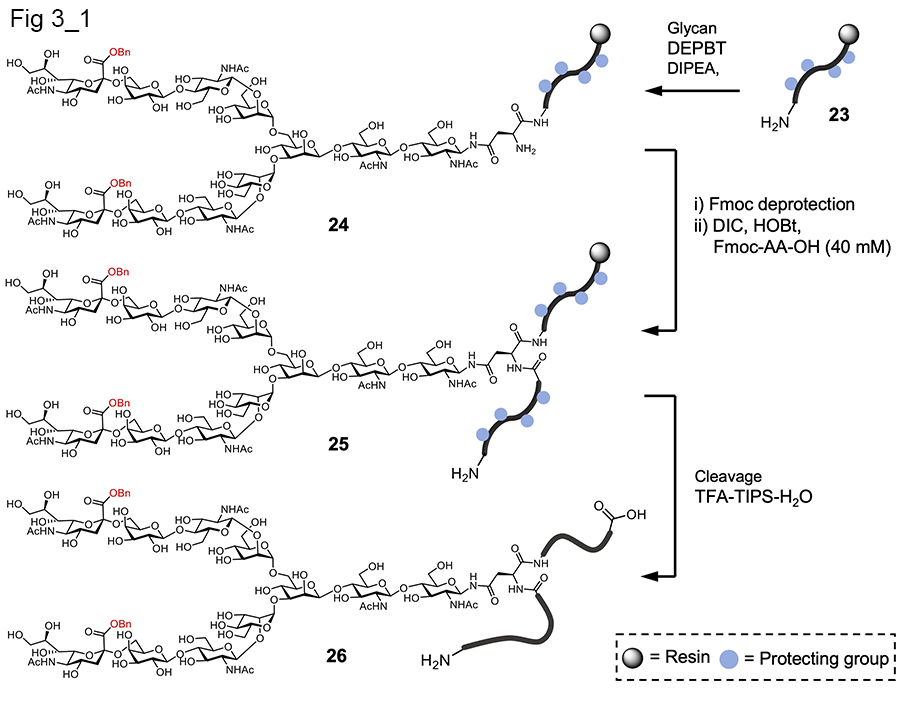
様々な糖鎖が世界中で化学合成されてきたが、糖ペプチド、特にその糖鎖末端にシアル酸が結合したものへの応用合成は確立されていなかった。理由としては2つ挙げられる。一般的に糖鎖は、酸に不安定なシアリル結合を持つこと、ならびに水酸基を30個近くもつ糖鎖という大きな分子をペプチドに組み込む方法が確立されていなかったことである。当研究室では、まず、シアル酸がなぜ酸に不安定なのかを明らかにした。その結果、シアル酸がもつカルボン酸が自身のグリコシル結合を加水分解する触媒基であることを突き止めた。そこで、このカルボン酸をベンジルエステルで保護した。その結果、固相合成で使用するトリフルオロ酢酸程度ではシアル酸が糖鎖から欠落しないようにすることに成功した。また、鶏卵から単離したN型糖鎖―アスパラギンは、その糖鎖の水酸基は無保護のまま糖鎖ペプチド固相合成に利用できるようにした [22] (図3-1)。これまでの知見では、糖水酸基が遊離であると、SPPSの実施時に、糖水酸基にアミノ酸が結合し、副生成物になるという問題があった。しかし、梶原らは、条件を検討し、糖水酸基にアミノ酸が導入されない条件を見出すことに成功し、大型のN型糖鎖をもつ糖ペプチドならびに、シアル酸が結合した糖ペプチドを固相合成で合成できるようにした。
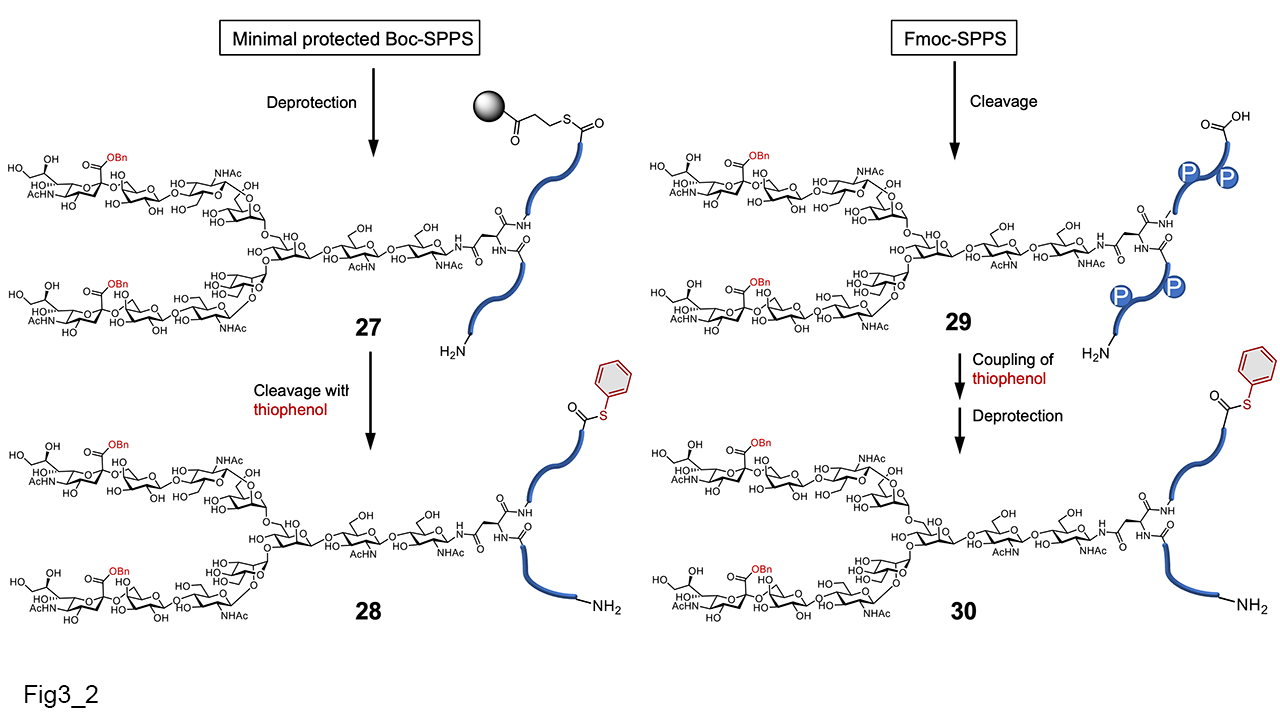
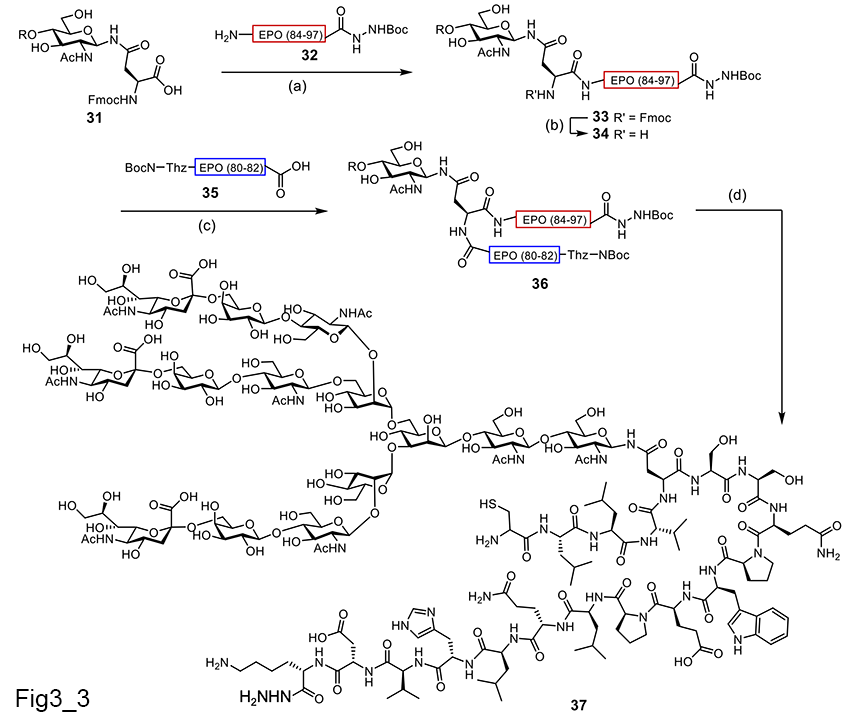
しかし、糖ペプチドの固相合成のプロトコールは確立されたが、NCLに利用するチオエステル型の糖ペプチドの化学合成はまだ困難であった。一般的なペプチドチオエステル合成法では、酸を使ってアミノ酸の保護基を脱保護するBoc-SPPSを用いるが、最後の工程であるペプチド側鎖の保護基の除去のために強酸性条件(HF)が必要である。この条件では、ベンジルエステル化しているシアル酸でもシアリル結合が切断される可能性があった。そこで種々検討し(2008年時点)、梶原グループは糖ペプチドチオエステルの合成法として、保護基が導入されたアミノ酸を最小限使用するBoc-SPPSと、Fmoc-SPPS法による糖ペプチドチオエステル合成法を2つ報告した[23](図2-2)。また、梶原グループは、酸に弱い、シアリル糖鎖ペプチドチオエステルは、2012年にBoc法で合成できるようその方法を確立したが、それまでは、保護基が導入されたアミノ酸を最小限使用するBoc-SPPSを利用した。 また、当研究室の真木らは三分枝糖鎖を用い、液相で糖ペプチドチオエステル誘導体の合成法を報告した21(図3-3:糖ペプチドの液相合成)。